作为 WB 的新手或老手,可能已经对 WB 实验要点了然于胸,例如,需使用新鲜样本,根据蛋白分子量选择合适孔径的转印膜,根据抗体选择适当的稀释液,根据 ECL 液灵敏度调整二抗稀释度等等。
但是,作为细节决定成败的实验,仍有几个极易被忽视的细节和问题。
Q1:什么是 WB 阳性对照?β-actin 难道不是阳性对照吗?
Q2:用什么裂解液裂解样本?
Q3:WB 需要超声吗?
Q4:对于磷酸化蛋白,封闭需要用 BSA 吗?
1)究竟什么是 WB 实验的阳性对照?为什么要设立阳性对照?
阳性对照(Positive Control)是已知或公认有目的蛋白表达的样本。当对一个靶标并无检测经验时,在实验初期,强烈建议增加阳性对照帮助排查一系列问题,例如,待测样本中该靶标的表达量、操作步骤、抗体表现等。
而内参蛋白如 β-actin, GAPDH 等,一般在样本中高表达,作为管家蛋白而用来对比不同样本间的上样量 (Loading Control),并非目的蛋白的阳性对照。
与阳性对照相对应的,还有阴性对照,即不表达靶标蛋白的样本。如图 1 所示,利用使用抑制剂或生长因子处理,制备针对 p-AKT(Ser473) 的阴性或阳性对照。
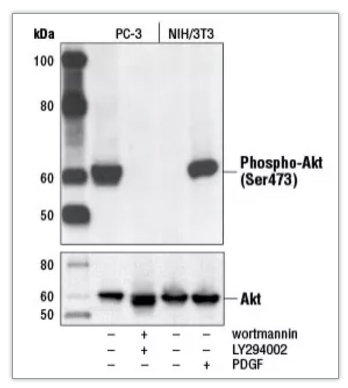
图 1:使用 Phospho-Akt (Ser473) (D9E) XP® Rabbit mAb #4060(上)或 Akt (pan) (C67E7) Rabbit mAb #4691(下),对未经处理或经 LY294002/Wortmannin 处理的 PC-3 细胞、经血清饥饿或 PDGF 处理的 NIH/3T3 细胞提取物进行蛋白质印迹分析。
如何选择阳性对照?
a. 总蛋白的阳性对照
选用明确表达该蛋白的细胞或组织样本;可参考说明书示例图或数据库。如下图所示,Saos-2 细胞高表达 RUNX2,适宜作为阳性对照样本,而 LNCaP 细胞不表达该靶标。
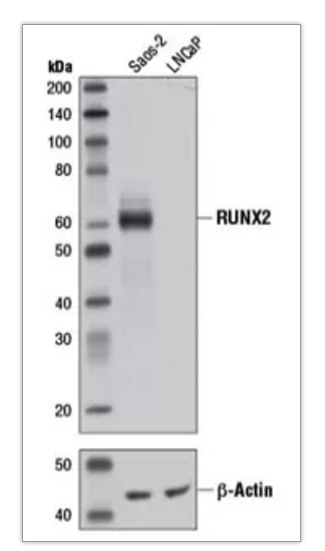
图 2:使用 RUNX2 (D1L7F) Rabbit mAb #12556 和 β-Actin (D6A8) Rabbit mAb #8457, 对 Saos-2 和 LNCaP 细胞的提取物进行蛋白质印迹分析。
b. 翻译后修饰蛋白的阳性对照
并非所有的细胞都有基础的翻译后修饰水平(如磷酸化)的表达。如图 3 所示,不同的细胞 p-AKT(Ser473) 的基础水平差别非常大。有些靶标需要合适的刺激条件(包括诱导因子、剂量和时间窗)使蛋白获得修饰。您可查看说明书、阳性对照处理表,或者通过广泛阅读文献,了解处理方式,并结合预实验摸索条件。
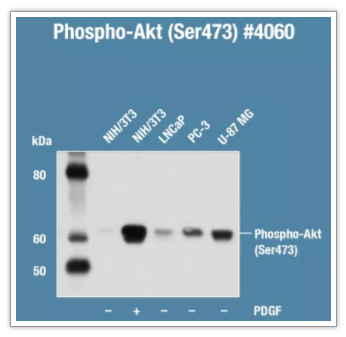
图 3:使用 Phospho-Akt (Ser473) (D9E) XP® Rabbit mAb 检测不同样本中靶标的表达。
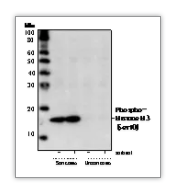
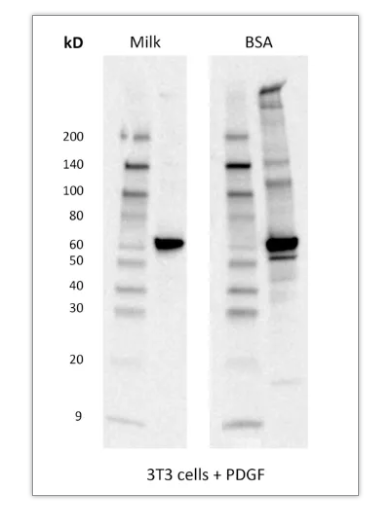
2)裂解样本用什么裂解液? 选择裂解液的考虑因素为样本种类:细胞,组织还是分离出的细胞组分。 对于全细胞裂解,建议使用 Cell Lysis Buffer(#9803)、RIPA 缓冲液(#9806)或 SDS 上样缓冲液 (#7722)。Cell Lysis Buffer 由于不含会使蛋白变性的强力去垢剂,仅含 1%Triton,使其可在多种实验中被使用(如 WB、IP)。RIPA 缓冲液含有 NP40 和脱氧胆酸钠,变性能力更强,可以裂解细胞或者组织。SDS 上样缓冲液也可以裂解细胞样本,但会干扰后续的 BCA 测定。 使用裂解液裂解时,需提前加入蛋白酶抑制剂或磷酸酶抑制剂,以抑制内源性蛋白酶对细胞蛋白的降解和磷酸酶的去磷酸化作用。阅读裂解液说明书,来明确是否需要额外添加蛋白酶抑制剂(PMSF #8553 或 Protease Inhibitor Cocktail #5871)或者磷酸酶抑制剂(Phosphatase Inhibitor Cocktail #5870)。对于 Cell Lysis Buffer(#9803)、RIPA 缓冲液(#9806),仅需补充 PMSF 即可。 对于细胞组分分离,则可以通过组分分离试剂盒完成。Cell Fractionation Kit #9038 可方便快速的分离细胞组分用于下游分析,通过移液和离心的方式,分步获得细胞组分(图 4)。 图 4:使用 Cell Fractionation Kit #9038,对 HeLa 细胞的细胞组分进行蛋白质印迹分析,结果表明蛋白在细胞浆、细胞器/膜以及胞核/细胞骨架的定位。全细胞裂解物 (WCL) 表示总蛋白。细胞浆蛋白 (Cyto) 使用 CIB 缓冲液进行分离。膜和细胞器蛋白 (Mem) 使用 MIB 缓冲液进行分离。胞核和细胞骨架蛋白 (Nuc) 使用 CyNIB 缓冲液分离。 3)裂解后是否需要超声? 样本裂解后,建议进行超声。超声可以破坏膜结构,断裂 DNA,降低样本的粘稠度,让样本更加均质化,增加蛋白的溶解,提高实验结果的一致性。对于核蛋白或者膜相关蛋白,超声步骤尤为重要 (图 5)。 超声步骤为冰上 3 次 5 秒的超声(50% 输出功率),控制超声探头位置,避免产生气泡。如没有超声仪,可用 1 mL 注射器针头,冰上反复抽打裂解液 5~10 次,达到类似于超声的效果。 图 5:使用 Phospho-Histone H3 (Ser10) Antibody#9701 对超声或者未经超声处理的细胞裂解液进行检测 4)封闭:BSA 还是奶粉? 封闭的目的是减少由一抗或二抗的非特异性结合引起的背景。BSA 仅含有一种蛋白质,分子量为 60KD。而奶粉则含有多种蛋白质,所以封闭作用更佳(图 6)。 有文章指出奶粉中的磷酸酶可影响磷酸化信号,那磷酸化蛋白还能用牛奶吗?我们的回答:是的。二十余年的磷酸化蛋白抗体研发经验告诉我们,新鲜配置的牛奶不会对磷酸化信号产生任何影响,但随着牛奶储存时间的延长(即便在 4 ℃),就可能使磷酸化信号下降。且牛奶封闭更加全面,使得磷酸化靶标识别特异性更佳。 图 6:使用 Phospho-Akt (Thr308) (D25E6) XP® Rabbit mAb #13038,检测经 PDGF 处理的 3T3 细胞样本,BSA 封闭的结果中可见背景和杂带,而牛奶封闭的结果背景更干净,信号强且清晰。 封闭时使用 5% 脱脂奶粉-TBST,摇床上室温封闭 1 h。如后续使用荧光发光法,则封闭时不可含有 Tween® 20。二抗孵育时,也推荐用 5% 脱脂奶粉-TBST 稀释二抗,降低背景。注意,需使用实验级脱脂奶粉(Nonfat Dry Milk #9999),食品级奶粉不可用于实验。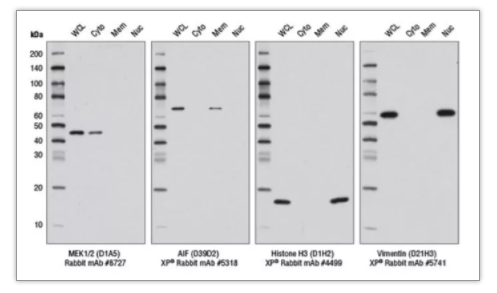
 在线客服1号
在线客服1号




