WB是检测蛋白质及蛋白质翻译后修饰的经典方法,可在简单或复杂的生物样品中提供有关靶蛋白的半定量或定量数据,WB步骤复杂,
通常包括:蛋白样本制备→电泳→转膜→封闭→孵育一抗→孵育二抗→显影→分析,
WB任何过程中出现的漏洞均可影响结果的灵敏度和重复性,必须注意将WB的每个步骤标准化,今天给大家分享WB各个过程中需要注意的细节!!! 按组织净重(g):裂解液体积(ml)=1:10的比例加入相应体积的裂解液(加入终浓度为1mM的PMSF、适当浓度的蛋白酶抑制剂和磷酸化酶抑制剂,以避免内源性酶分解蛋白,影响蛋白质的抽提)进行匀浆。 蛋白质的样品制备是westemblotting的第一步,也是关键步骤,要想获得所有蛋白质,应注意以下问题: (1)在合适的盐浓度下,应保持蛋白质的最大溶解性和可重复性; (2)选择合适的表面活性剂和还原剂,破坏所有非共价结合的蛋白质复合物和共价二硫键,使其形成各自多肽的溶液; (3)尽量去除核酸,多糖,脂类等分子的干扰,在裂解完毕离心之后小心取中层澄清溶液,注意不要吸到底层沉淀和上层脂类; (4)防止蛋白在处理过程中的人为修饰,制备过程必须在低温下进行,以避免细胞破碎释放出各种酶类的修饰。(注意:可以适当加入PMSF等酶抑制剂) (5)样本制备完后分装保存,但是注意不要反复冻融。 30%的PAG配置完后过滤于4C保存,10% SDS室温保存。AP不稳定,用时现配。(注意:分子量较小的蛋白选用较大浓度的凝胶) 制胶关键是聚合时间,分离胶聚合控制在从加入10% AP和TEMED至开始凝胶,时间为10-20min(未完全凝聚),浓缩胶最佳聚合时间为8-10min,可通过控制AP和TEMED量来控制。AP和TEMED的量过高,局部胶疑的太快,会使疑胶不均匀,电泳蛋白条带会弯曲。环境温度较高时,应减少AP和TEMED的量。空气中氧气也会影响胶的聚合,所以在分离胶上面应加一层水或正丁醇以隔绝氧气。 (1)条带出现微笑现象(中间凹两边翘起):主要是凝胶中间部分凝固不均所致,应待凝胶充分凝固后电泳,或者催化剂加入后充分混匀; (2)条带出现“皱眉”现象(中间鼓坡两边向下):两玻璃板之间底部气泡所致,应排除底部气泡; (3)带出现拖尾现象:主要是样本溶解效果不佳,分离胶浓度过大,电泳缓冲液放置时间过长。建议:加样前离心,选择适当的样本缓冲液,加适量的样品促溶剂;使用新配置的电泳缓中液,降低凝胶浓度或使用梯度凝胶。 (4)蛋白条带出现纹理现象:样品不溶性颗粒引起的。建议:加样前离心,加入适量的促溶剂。 (5)指示的澳酚蓝已跑出底板,但蛋白质未跑下来:与缓冲液和分离胶的浓度有关应更换正确PH值的缓冲液,降低凝胶浓度或使用梯度凝胶。 湿式电转印注意事项: (1)要使蛋白质组分能有效的从凝胶转移到固相纸膜上,缓冲液的PH值很重要,有些分子量不是很大的蛋白质区带,即使延长电转印时间也不能从凝胶转移到膜上。这是由于蛋白质在转移缓冲液中恰好处于等电点状态造成的,因此应适当改变转移缓冲液的PH,以利于转膜。另外,对于分子量较小的蛋白质,可在缓冲液中加入适量甲醇,因为甲醇能促进它们固定在固相膜上。但是对于大分子量的蛋白质,尤其是碱性蛋白质,缓冲液中是不宜加入甲醇的,因为甲使凝胶孔径变小,不利于分子量较大的蛋白的转移,甲醇能将结合在碱性蛋白质上的SDS解离出来而使其带正电或呈电中性蛋白质就更难从凝胶中转移出来; (2)电转印膜的选择:有NC膜、重氮化膜和阳离子尼龙膜,PVDF膜。其中NC膜使用的最为普遍,它的蛋白质容量大,可用各种染色方法进行检测,但是它与蛋白质的结合是非价性的,膜干燥后很脆。此外膜的孔径大小也是考虑的重要因素,目的蛋白30KD以下用0.22 um孔径的NC膜,30KD以上用0.45 um孔径的NC膜; (3)转印选择恒流,每个转印槽150 mA,10KD以下转印40min,10-30KD转印50min,30-100KD转印70min,100kd以上转印80min,转印完毕可用丽春红S染膜检测转印是否成功,转印结束后去除NC膜置于丽春红S溶液中,室温5-10min即可看见红色条带,用TBS洗数次即可洗掉红色条带进行后续实验。 (1)电泳转膜过后,膜上其他没有结合蛋白质的空白位置需要用封闭液加以封闭,以避免一抗或二抗非特异性结合。这是由于WB的灵敏度很大程度上取决于封闭的好坏,封闭时间过长(过度封闭)导致抗原表位的遮蔽,从而降低检测灵敏度,封闭时间过短(不完全封闭)又会导致最终背景增高或信噪比太低,因此封闭液的选择和条件的优化很重要; (2)封闭液中应加入适量的防腐剂,避免封闭蛋白变性影响封闭效果。 (1)若非特异性条带过多,可适当降低抗体的浓度,增加洗膜次数,蛋白电泳前延长变性时间,减少上样蛋白量,延长封闭时间; (2)若信号弱,可能转膜不完全,可优化转移时间和电流,增加抗体的浓度,适当延长曝光时间; (3 )若背景较高,可适当降低抗体的浓度,过滤二抗,延长封闭时间,增加漂洗时间,减少曝光时间。 (1)胶片曝光几秒到数分钟,具体情况要看膜上化学发光条带明暗强度而定。胶片曝光时间不宜过长,时间过长会照成胶片背景变深。冲洗胶片以确定所测抗原的正确曝光时间; (2)冲洗胶片的步骤:曝光完的胶片先在显影液中冲洗至出现条带为止,一般在1min以内,时间过长也会照成胶片背景变深。再放入定影液中漂洗,十秒即可显影液漂洗完后,要多用清水冲洗,以免定影液中成分残留在胶片上。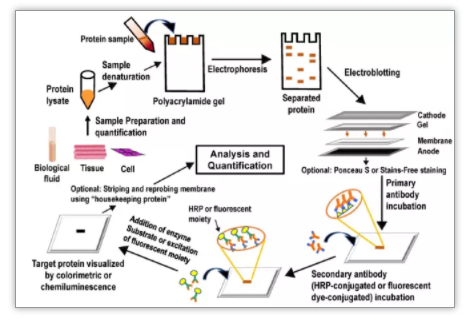

 在线客服1号
在线客服1号




