前段时间小编给大家分享了WB/ELISA/IHC三大实验的内容,今天小编就来给大家简要梳理一些WB流程中的一些细节,避免因某一环节出现差错而导致实验重做。
做蛋白研究的小伙伴都知道,一个完整的Western Blot包括了很多个步骤,从蛋白提取到配胶、上样电泳,再到转膜、封闭,最后孵育一抗二抗后才能去进行检测。时间跨度非常长,而且这中间的每一步都包含了很多的小细节,稍有不慎就会导致结果出错,然后又得从头来过。所以,关于WB,几乎每一位经验丰富的实验老手都有着一本厚厚的血泪史。
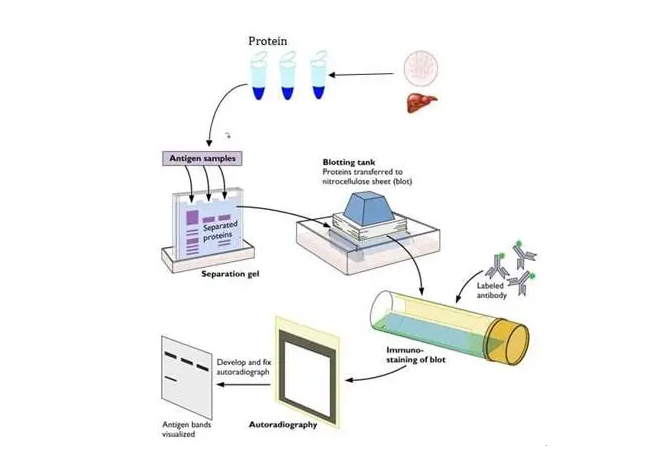
一:样品的获取与制备
一般来说我们检测的样本主要为细胞或者组织,制备的过程中尽量保持低温,其次在制备时一定要根据目的蛋白的特性选择合适的裂解液,比如对膜蛋白的提取、胞浆蛋白的提取和组织蛋白的提取等。
二:配胶、上样及蛋白电泳
配胶前将玻璃清洗干净烘干(用纸巾擦干/有时间50°C烘干)。晾干后根据蛋白分子量进行不同浓度凝胶配制,上样是需要把蛋白进行煮沸变性,如果进行定量分析一定要将所有蛋白上样量调制相同,电泳时低压(80V)跑浓缩胶,高压(120v)跑分离胶,至溴酚蓝即将跑出胶面时终止电泳。
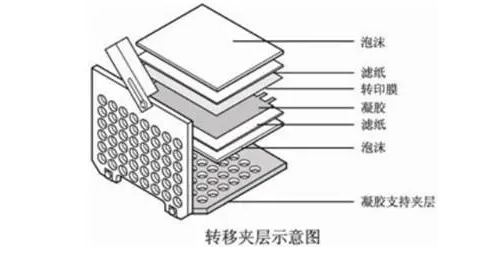
三:转膜及封闭
膜的选择主要从实验目的和实验要求来考虑。例如,要做分子量小于20kD的小蛋白,0.45μm的NC膜是不可取的,因为这样可能会使得蛋白因透过膜孔而造成膜结合的目的蛋白量不确定,从而影响到最终结果的可靠性。而如果所分离的蛋白需要进行测序,则非PVDF膜不可,因为只有PVDF膜才能经受住严酷的清洗条件。
建议转移之后迅速在 Tris-Buffered Saline (TBS) 中洗涤膜,以便移除残留的转移缓冲液,随后在室温条件下含5% 脱脂牛奶的 Tris Buffered Saline 和 Tween® 20 去污剂 (TBST)中封闭1小时。这一封闭步骤有助于降低非特异性一抗结合并降低背景。应避免膜封闭时间过长,因为这会掩盖抗原表位,阻止抗体结合。封闭后在TBST 中洗涤5分钟。
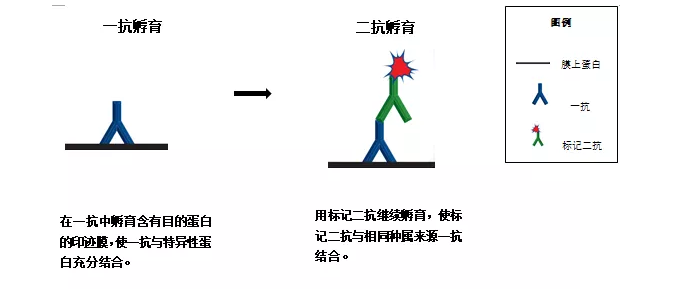
四:抗体的孵育和检测
抗体孵育:目的蛋白印迹在膜上,经过封闭之后,印迹目的蛋白与一个或多个抗体孵育。第一个抗体(一抗)与目的蛋白结合,而第二个抗体(二抗)与第一个抗体结合,二抗本身结合有酶或染料,可用来指示蛋白的位置。不过有些一抗也具有直接标记的功能,但使用标记二抗有明显优势。首先不止一个二抗分子能与单个一抗分子结合,形成信号;其次,标记的二抗可用于大量不同特异性的一抗,因而无需标记多个一抗。
直接western blot检测方法:在直接检测方法中,酶直接连接到一抗上。操作简单,检测步骤少。虽然直接检测是快速和直接的,但它往往比间接检测的灵敏度低,因为在这个过程中可以发生信号放大的步骤更少。此外,酶直接标记到一抗上可能会造成成本和资源上的限制。
间接western blot检测方法:间接检测方法比直接检测方法更受欢迎,主要是灵敏度更高。通过间接检测,识别感兴趣的抗原的抗体,称为一抗,检测是通过添加标记的二抗实现的,二抗可以识别一抗上的特定表位。这种表位通常是种属特异性的;例如,在兔体内产生的几种不同的一抗都可以被同一种抗兔二抗体所识别。
 在线客服1号
在线客服1号




