IHC(免疫组化)、ELISA(酶联免疫吸附试验)、WB (免疫印迹),是免疫学三大常用工具,分别用于定位,定性和定量。
WB(免疫印迹试验)即Western Blot。其基本原理是通过特异性抗体对凝胶电泳处理过的细胞或生物组织样品进行着色,将电泳分离后的细胞或组织总蛋白质从凝胶转移到固相支持物(NC膜或PVDF膜)上,然后用特异性抗体检测某特定抗原的一种蛋白质检测技术。 一蛋白质样品获得:细菌诱导表达后,可通过电泳上样缓冲液直接裂解细胞,真核细胞加匀浆缓冲液,机械或超声波室温匀浆0.5-1min。然后4℃,13,000r离心15min。取上清液作为样品。 二电泳:制备电泳凝胶,进行SDS-PAGE。 三转移:(半干式转移) 1、电泳结束后将胶条割至合适大小,用转膜缓冲液平衡,5min×3次。 2、膜处理:预先裁好与胶条同样大小的滤纸和NC膜,浸入转膜缓冲液中10min。 3、转膜:转膜装置从下至上依次按阳极碳板、24层滤纸、NC膜、凝胶、24层滤纸、阴极碳板的顺序放好,滤纸、凝胶、NC膜精确对齐,每一步去除气泡,上压500g重物,将碳板上多余的液体吸干。接通电源,恒流1mA/cm2,转移1.5hr。转移结束后,断开电源将膜取出,割取待测膜条做免疫印迹。将有蛋白标准的条带染色,放入膜染色液中50s后,在50%甲醇中多次脱色,至背景清晰,然后用双蒸水洗,风干夹于两层滤纸中保存,留与显色结果作对比。 四免疫反应: 1、用0.01M PBS洗膜,5min ×3次。 2、加入包被液,平稳摇动,室温2hr。 3、弃包被液,用0.01M PBS洗膜,5min×3次。 4、加入一抗(按合适稀释比例用0.01M PBS稀释,液体必须覆盖膜的全部),4℃ 放置12hr以上。阴性对照,以1%BSA取代一抗,其余步骤与实验组相同。 5、弃一抗和1%BSA,用0.01M PBS分别洗膜,5min×4次。 6、加入辣根过氧化物酶偶联的二抗(按合适稀释比例用0.01M PBS稀释),平稳摇动,室温2hr。 7、弃二抗,用0.01M PBS洗膜,5min×4次。 8、加入显色液,避光显色至出现条带时放入双蒸水中终止反应。 蛋白样本建议加入上样缓冲液煮沸变性后保存,对于稀有样本建议分装 于-80°C保存 条带迁移过快,降低电压; 胶凝固不均匀,正确制备凝胶; 样品内有不溶物,离心或者优化样本蛋白提取; 上样量过载,降低上样量; 使用凝胶浓度不合适,蛋白分辨率较低,调整交联剂比例; 电泳液反复使用多次,重新配置新鲜电泳液; 胶界面不平导致歪斜货凝胶制备不均匀; 样本中盐离子浓度过高,干扰泳; 电压过高,电泳迁移过快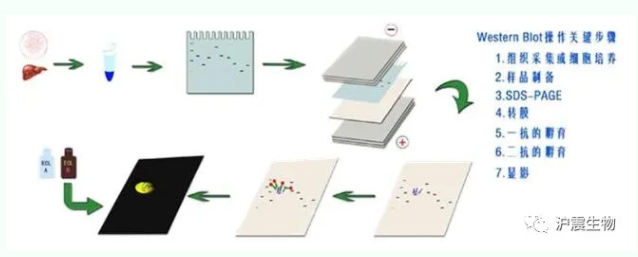
可能原因 建议 抗体浓度太高了 优化/降低一抗和二抗的浓度 上样蛋白量太少 增加样品的量 转移效率太低 改进转移实验步骤。确保PVDF膜用之前用甲醇预孵育 一抗已经被用很多次了 使用重新稀释的一抗 封闭不充分 延长封闭时间,更换核实的封闭剂(脱脂奶粉、BSA、酪蛋白) 抗体与其它蛋白质交叉反应 更换不同的封闭液;勿在含生物素体系中使用脱脂奶粉封闭;降低二抗浓度;检测二抗与膜的交叉反应性。 洗膜不充分 增加洗涤次数 膜干燥 保证充分的反应液,避免出现干燥现象 一抗或二抗的孵育时间太短 延长孵育时间 叠氮化钠可能抑制二抗 溶解缓冲液中应避免使用叠氮化钠 可能原因 建议 检测样品不表达目的蛋白 选择表达量高的细胞作为阳性对照,确定检测样品是否为阴性 检测样品低表达目的蛋白 提高上样量,裂解液中加入蛋白酶抑制剂 膜漂洗过度 减少漂洗的时间和次数 抗体 增加抗体浓度;更换有效抗体(抗体失效) 抗原不足 增加上样量 抗原被封闭液遮蔽 试用不同的封闭液;优化封闭液中蛋白质浓度;缩短封闭时间 蛋白质样品在存储过程中降解 重新制备样品 一抗失效 使用有效期内抗体,分装保存,避免反复冻融取用,工作液现配试用 可能原因 建议 样本目的蛋白表达量过低或无表达 确认样本可行性,对表达过低的样本进行富集后在进行式样 蛋白提取过程中降解 蛋白提取时,保持低温状态,并加入蛋白酶抑制剂 蛋白样本保存条件不合适,蛋白降解 看题赋予弄滴过低或时间过短 优化抗体孵育量,一抗建议4°C过夜孵育 一抗二抗检测体系不匹配 选择合适的一抗二抗 抗体失活 争取保存抗体 显影液使用时间过长 使用新鲜试剂,并避光保存 可能原因 建议 反影或膜上可见黄色条带 一抗二抗体浓度过高或样本上样量过大,导致美被瞬间消耗 白色空点 转膜三明治制备是有气泡,或者抗体孵育不均匀,应震荡孵育 黑色斑点背景 封闭液颗粒残留,在使用前应充分搅拌溶解 微笑条带 皱眉条带 电泳时,电泳丝底物聚集大量气泡,导致电压不均衡 条带拖尾 条带扭曲
 在线客服1号
在线客服1号




